民進黨“一苗兩制” 聯亞疫苗未通過EUA高端卻輕鬆過關斬將

台灣自産聯亞新冠肺炎疫苗申請緊急用戶許可證(EUA)闖關失敗。臺當局衛福部門主管陳時中16日在疫情防控記者會表示,聯亞疫苗未過關的原因在於“效力不足”,因此,被民進黨當局一路護航的高端疫苗成為台灣唯一自産疫苗,將於23日開始施打,首波將供貨61.4萬劑予36歲以上民眾注射。據了解,臺當局領導人蔡英文預約23日接種,而曾經表示“手臂要留給聯亞”的臺當局副領導人賴清德也將登記施打高端疫苗。
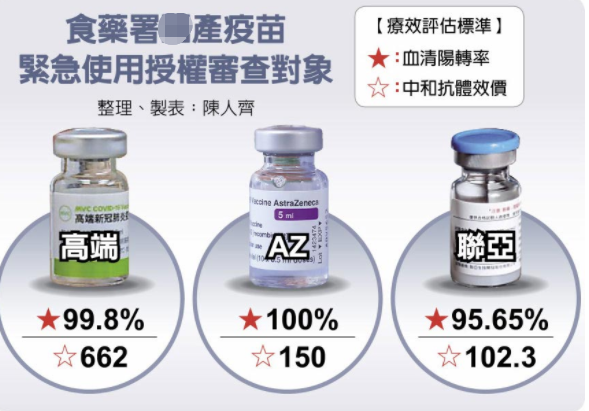
據台灣《中國時報》報道,臺衛福部門“食藥署”在週日(15日)召開專家會議審查聯亞疫苗EUA,在21名專家投票中,有17人不同意,另4人要求補件再議。
“食藥署長”吳秀梅説,聯亞疫苗未通過原因在於,中和抗體數據結果未達免疫橋接的不劣性標準,建議繼續依原計劃進行三期臨床試驗。陳時中則簡單地説,“聯亞未通過的原因就是效力不足”。
圖片來源:台灣《中國時報》
聯亞生技表示,對於無法取得EUA審核深感遺憾,然而“食藥署”並未完整呈現聯亞生技UB-612疫苗設計特性,實為民眾重大損失,將提出申訴。
臺衛福部門“疾管署”在5月28日與高端、聯亞完成簽約,每家採購500萬劑疫苗,含開口合約最多各採購1000萬劑。如今聯亞EUA未過,本土疫苗是否出現空缺?陳時中卻一再宣稱,臺當局採購的疫苗早已超越原先預定的數量,“目前疫苗數量足夠,聯亞若能進來,可能會早一點能有足量,但即使少了聯亞,疫苗總量仍充足。”至於聯亞已先生産的200多萬劑疫苗,陳時中表示,會給予適當的材料費用補償。
臺專家:臺當局疫苗效力評估標準沒有科學依據
對於民進黨當局所採用的疫苗效力評估標準,臺“中研院”院士陳培哲表示,以比較中和抗體數據判斷疫苗效力、作為是否通過緊急使用授權的標準沒有科學依據,因這一數據並不能代表實際接種疫苗後産生的保護力。台灣本地疫苗取得緊急使用授權,必須以世界通用標準為主。
聯亞疫苗臨床試驗總主持人、台灣中國醫藥大學附設醫院感染管制中心副院長黃高彬表示,聯亞的抗體效價較低不代表保護力較差,因為疫苗不能單看抗體效價數據,還要考慮T細胞反應的問題,不過既然臺當局訂出要用抗體效價來當審查標準,那也只能照這樣的規則來走。這次審查聯亞敗在中和抗體效價這關,算是非戰之罪,實際上聯亞的中和抗體效價數字仍比高端漂亮的多,“但沒過就沒過,接下來就是繼續精益求精,再求進步。”
至於是否比照高端疫苗公開專家審查會議紀錄,陳時中表示,由於沒通過EUA,因此沒什麼好公開的。對於聯亞表示將至印度進行第三期臨床試驗,指揮中心發言人莊人祥説,聯亞疫苗如經第三期臨床試驗證實具保護力,採購合約仍適用。
不過,曾為聯亞受試者的前“衛生署長”楊志良認為,臺當局應該公開兩邊相關審查資料,“讓大家看看聯亞還有哪些地方要跟高端學習?高端又是哪些地方優於聯亞?大家一起互相學習。”也讓聯亞比較服氣。
楊志良指出,台灣是高度政治對立的社會,既然現在都確定了,就應該把所有數據公開,他更擔憂,接下來開始大量施打高端將會是一場政治豪賭,若賭贏,老百姓幸福,若賭輸,現在Lambda病毒都出來了,到時候高端防護力不夠,一旦沒有防護力,將來施打高端的人可能都會染病成大破口。
3800名聯亞受試者怎麼辦?

自産聯亞疫苗沒有通過緊急授權EUA,至於3800名受試者接下來該怎麼辦?臺衛福部門主管陳時中曝2種選擇。圖片來源:台灣《中時電子報》
關於參加聯亞第二期人體臨床試驗的3800多名受試者接下來該怎麼辦?陳時中表示,將依照受試者意願,協助安排接種其他疫苗,可以打其他廠牌,也可以等聯亞第三期臨床試驗。
指揮中心指出,參與聯亞臨床試驗的受試者,簽署受試者同意書時已充分告知,試驗過程中可隨時退出試驗,且不需任何理由,臨床試驗受試者于退出或完成試驗後之後續疫苗施打規劃,將專案處理,接種前應與醫師討論身體狀況,並經專業評估相關風險後再接種疫苗。
據了解,聯亞疫苗第二期臨床試驗收案約3800人,包括12至18歲青少年、19至64歲的成人,以及65歲以上的長者。陳時中表示,若受試者想接種台灣現有的疫苗,會協助安排其他廠牌的疫苗接種,由於聯亞仍可繼續執行第三期人體臨床試驗,未來可循一般疫苗上市程式,向“食藥署”申請藥證,如果受試者要等到第三期臨床試驗,也尊重受試者意願。【華夏經緯網綜合報道】


